APORTACIONES AL MODELO ATÓMICO ACTUAL
- 400 a.C. : Demócrito y LeucipoDemócrito y Leucipo propusieron la primera teoría atómica llamada la "Discontinuidad de los átomos". Esta consistió en que la materia se podía dividir indeterminadamente en partículas cada vez más pequeñas hasta obtener unas diminutas e invisibles a las que llamaron átomos.
La teoría atomística de Demócrito y Leucipo dice así:
- Todas las cosas están compuestas de átomos sólidos.
- Espacio vacío, es decir, vacuidad, existe entre los átomos.
- Los átomos son eternos.
- Los átomos pueden ser demasiado pequeños, no son visibles.
- Los átomos son indivisibles, homogéneos e incomprensibles.
- Los átomos se diferencian en forma y tamaño.
- Las propiedades de la materia varían según el agrupamiento de los átomos.
 |
| http://www.quimicaweb.net/grupo_trabajo_fyq3/tema4/imagenes/200px-Leucippus.jpg |
Empedócles postuló que la materia estaba formada por 4 elementos: Agua, fuego, tierra y aire.
 |
| http://www.quimicaweb.net/grupo_trabajo_fyq3/tema4/imagenes/4element.gif |
 |
| http://lh6.ggpht.com/_aaKhSsDhq_c/TXAHTzxSWKI/AAAAAAAAA_k/0qBLeueraYY/modelo%20atomico_thumb%5B7%5D.png?imgmax=800 |
 |
| http://www.biografiasyvidas.com/monografia/aristoteles/fotos/aristoteles_420.jpg |
Dalton y el primer modelo atómico
 |
El inicio de la Teoría atómica fue de gran importancia para la ciencia, con ello se pretendía comprender el comportamiento de las sustancias durante los experimentos y así darles una explicación. Dalton es el iniciador de esta revolución científica. A continuación revisaremos su trabajo.
Datos biográficos
Químico y físico británico (1766 - 1844) que conjuntó las ideas que hasta el momento se tenían sobre la estructura de la materia.
De los árabes tomó sus principios: creían que la transformación de un elemento en otro sería posible mediante un elíxir y producirían radiaciones (hay semejanza con el concepto de las reacciones nucleares) y los utilizó como operaciones unitarias (transferencias, cambio de energía y materiales en procesos físicos y físicoquímicos); de los persas retomó el concepto de volatilidad para los procesos de cambio de estado, de Lavoisier, el concepto de lo permanente para la conservación de la materia; de Leucipo la palabra “átomo” y lo asocia con el de “elemento” de Boyle; todo lo anterior le permitió elaborar una serie de hipótesis de trabajo que explicaban su posición ideológica sobre la estructura de la materia que llamó postulados, es el inicio de la Teoría atómica.
Primer postulado
Las sustancias se pueden dividir hasta partículas indivisibles y separadas llamadas átomos.
 |
| http://portalacademico.cch.unam.mx/materiales/al/cont/exp/qui/qui1/u2/mod_atomicos/img/q1u2oa10i11.jpg |
Segundo postulado
Tercer postulado
Cuarto postulado

Los átomos de un mismo elemento son iguales esencialmente en masa y propiedades, los de otros elementos tienen diferente masa y no se pueden crear o destruir.
En la imagen del lado izquierdo se presentan las marcas arbitrarias o signos que Dalton eligió para representar los diversos elementos químicos. En la imagen del lado derecho están los compuestos que se forman a partir de los elementos.
En la imagen del lado izquierdo se presentan las marcas arbitrarias o signos que Dalton eligió para representar los diversos elementos químicos. En la imagen del lado derecho están los compuestos que se forman a partir de los elementos.
 |
| http://portalacademico.cch.unam.mx/materiales/al/cont/exp/qui/qui1/u2/mod_atomicos/img/q1u2oa10i19.jpg |
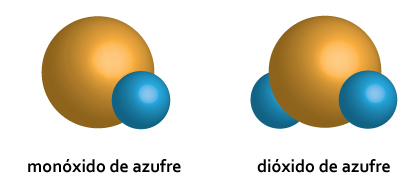
Al combinarse dos o más átomos forman un compuesto y la fracción más pequeña de éste es un átomo compuesto, integrado por átomos compuestos idénticos en una relación numérica sencilla de átomos de cada elemento que lo conforma.
Este ejemplo ocurre cuando se combina el azufre y el oxígeno.
Este ejemplo ocurre cuando se combina el azufre y el oxígeno.
 |
| http://portalacademico.cch.unam.mx/materiales/al/cont/exp/qui/qui1/u2/mod_atomicos/img/q1u2oa10i10.jpg |
En una reacción química, los átomos se reacomodan para formar nuevos compuestos.
 |
| http://portalacademico.cch.unam.mx/materiales/al/cont/exp/qui/qui1/u2/mod_atomicos/img/q1u2oa10i12.jpg |
Thompson, el “budín con pasas"

Los experimentos que dieron origen a la propuesta del modelo atómico de Thompson se realizaron en 1897 sin embargo, los reportó hasta 1902; en éstos considera al átomo como una gran esfera con carga eléctrica positiva, en la que se distribuyen los electrones como pequeños granitos al que llamó “budín con pasas”, este modelo lo retoma Millikan en 1909 con sus experimentos de “la gota de aceite” en donde logra determinar la carga negativa del electrón.
Partiendo del modelo de Thompson y la identificación de la partícula con carga negativa llamada electrón, fue posible explicar posteriormente cómo se unen los compuestos que hoy se conocen como enlaces, las reacciones de electrólisis con los iones positivos y negativos, entre otras aportaciones; sin embargo, se seguía considerando al átomo continuo pero divisible.
 |
| http://portalacademico.cch.unam.mx/materiales/al/cont/exp/qui/qui1/u2/mod_atomicos/img/q1u2oa10i15.jpg |
Rutherford y el núcleo (ER)

Rutherford, basó sus estudios en las partículas alfa, para estudiar su comportamiento colocó en una caja de plomo una muestra de radio y a cierta distancia una pantalla fluorescente y entre ambos una lámina de oro con un grosor de 4 x 10-5 m y observo lo siguiente:
La mayoría de las partículas alfa atraviesan la lámina de oro sin sufrir ninguna desviación, entonces debía haber espacios vacíos entre los átomos de oro.
Una de cada 40,000 partículas alfa se desvían en un ángulo mayor de 90° en la lámina de oro, esto implicaba la existencia de un núcleo con carga positiva que provoca esta desviación.
Una de cada 40,000 partículas alfa rebotaban en la lámina de oro, esto implicaba la existencia de un núcleo con carga positiva.
Con estas conclusiones propone su modelo atómico que consiste en:
 |
| http://depa.fquim.unam.mx/QI/contenido/periodicidad_archivos/image012.gif |
El centro del átomo está constituido por el núcleo donde reside su masa con carga positiva, a la que llamó protón, y una atmósfera electrónica compuesta de órbitas indeterminadas en las que se encuentran los electrones como el sistema planetario, por lo que debe haber espacio vacío; sin embargo, se tenían algunas dudas sobre este modelo y fue hasta 1920 que James Chadwick , con experimentos semejantes a los de Rutherford lo confirma y además descubre una partícula atómica con una masa igual a la del protón y sin carga a la que llamó neutrón .
 |
| http://byjus.com/chemistry/wp-content/uploads/2015/12/atom1.png |
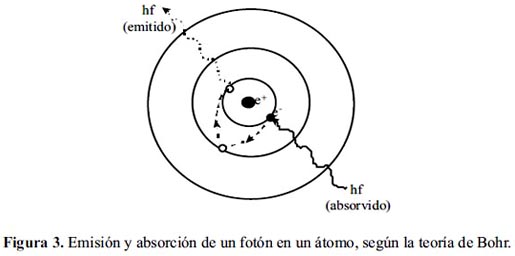
Bohr y el átomo

Niels Bohr (1885-1962) físico danés, propuso dar una explicación de por qué los elementos presentaban los espectros de emisión y absorción y por qué eran diferentes unos de otros, para ello retomó los trabajos de Max Planck acerca de los cuantos o fotones y de Gustav Kirckhoff quien estudió el color que emitía la flama del mechero cuando quemaba algunas sustancias.
Bohr supuso que los electrones se encuentran y giran en órbitas definidas y que cada una contiene una cantidad de energía, por esta razón los llamó niveles de energía.
Planteó que en estado basal los electrones se encuentran girando en torno a su nivel de energía, pero que éstos pueden pasar de uno a otro, para ello necesitan absorber energía, si el electrón “salta” a un nivel de energía superior adquieren un estado excitado y se produce un espectro de absorción.
Al regresar a su estado basal emiten energía en forma de luz o fotones y producen un espectro de emisión. El éxito del modelo de Bohr consistió en que pudo predecir con precisión basándose en su modelo el espectro del Hidrógeno.
Bohr supuso que los electrones se encuentran y giran en órbitas definidas y que cada una contiene una cantidad de energía, por esta razón los llamó niveles de energía.
Planteó que en estado basal los electrones se encuentran girando en torno a su nivel de energía, pero que éstos pueden pasar de uno a otro, para ello necesitan absorber energía, si el electrón “salta” a un nivel de energía superior adquieren un estado excitado y se produce un espectro de absorción.
Al regresar a su estado basal emiten energía en forma de luz o fotones y producen un espectro de emisión. El éxito del modelo de Bohr consistió en que pudo predecir con precisión basándose en su modelo el espectro del Hidrógeno.
Los experimentos de Planck y Kirckhoff junto con la propuesta del modelo de Rutherford, permitieron a Bohr proponer un nuevo modelo compuesto por 3 postulados cuyos principios aplican al átomo de hidrógeno:
- En el átomo de hidrógeno el electrón gira alrededor del núcleo en una órbita circular que tiene una energía fija y definida.
- Momento angular: El electrón de hidrógeno sólo puede girar en órbitas cuantizadas (es decir con cierto contenido energético) cuyo radio cumpla con el momento angular.
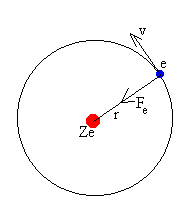
http://www.sc.ehu.es/sbweb/fisica/elecmagnet/movimiento/bohr/bohr.gif - Cuando un electrón pasa de una órbita externa a una más interna, la diferencia de energía entre ambas órbitas se emite en forma de radiación electromagnética.
http://www.scielo.org.pe/img/revistas/rsqp/v79n2/a11fig03.jpg
Aportaciones
Explica que la energía del electrón no se pierde y por lo tanto no cae al núcleo.
Las órbitas del átomo son circulares.
Las propiedades químicas de los elementos están determinadas por los electrones del último nivel (electrones de valencia). Describe con precisión el espectro del hidrógeno.
Las órbitas del átomo son circulares.
Las propiedades químicas de los elementos están determinadas por los electrones del último nivel (electrones de valencia). Describe con precisión el espectro del hidrógeno.
Limitaciones
No logra explicar (predecir con precisión) los espectros de otros elementos.
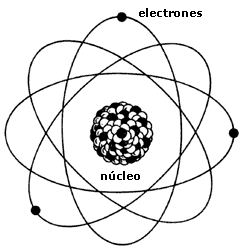
Estructura del átomo: Modelo Actual
Según esto, el átomo quedó constituido así:
- Una zona central o NÚCLEO donde se encuentra la carga total positiva (la de los protones) y la mayor parte de la masa del átomo, aportada por los protones y los neutrones.
- Una zona externa o CORTEZA donde se hallan los electrones, que giran alrededor del núcleo.
Hay los mismos electrones en la corteza que protones en el núcleo, por lo que el conjunto del átomo es eléctricamente neutro.
 |
| http://www.quimicaweb.net/grupo_trabajo_fyq3/tema4/imagenes/atomo9.gif |
Partículas Subatomicas
Las partículas son fragmentos muy reducidos de materia que, pese a sus diminutas dimensiones, mantienen intactas las propiedades químicas de una sustancia. El adjetivo subatómico, por otra parte, menciona al nivel de una estructura que resulta más pequeño que el del átomo.
Número Atómico (Z)
Es el número de protones en el núcleo de cada átomo de un elemento.
Número de masa (A)
El número de masa es el total de protones y neutrones presentes en el núcleo del átomo de un elemento.
A= Número de masa = número de protones + número de neutrones.
Z = Número de protones = número de electrones* .
A- Z = Número de neutrones.
Números Cuánticos
Los números cuánticos son parámetros que describen el estado energético de un electrón y las características de un orbital.
Los 3 primeros números cuánticos (principal, secundario, magnético) son obtenidos como consecuencia de la resolución matemática de la ecuación de onda de Schrödinger, mientras que el cuarto número cuántico (spin magnético) lo introdujo Paul Dirac en 1928, reformulando la ecuación de onda.
Los principios que sustenta la teoría de la mecánica-cuántica son: principio de dualidad onda-partícula para el electrón y principio de incertidumbre de Heinsenberg el cual señala que no se puede determinar el momento y lugar a la vez de la posición de un electrón, sin embargo es posible determinar la región mas probable donde se puede encontrar (orbital).
Principio de exclusión de Pauli: "Dos electrones en u mismo átomo no pueden tener los cuatro números cuánticos iguales"
Configuración electrónica lineal
El principio de edificación progresiva o regla de AUF-BAU nos dice que "cada nuevo electrón añadido a un átomo entrara en el orbital disponible de mínima energía" La separación de energía en los subniveles de los átomos polielectrónicos origina que se superpongan o traslapen, en valor de energía, orbitales con diferente valor de n. considerando las energías relativas de los orbitales de un átomo polielectrónico, el orden de ocupación será el siguiente.
 |
| http://tiempodeexito.com/quimicain/images/conf1.jpg |
Configuración electrónica gráficas
Estas configuraciones son una aplicación de la estructura electrónica que nos hace una descripción detallada, pues consideran al cuarto parámetro cuántico spin. PAULI propone un principio de exclusión que nos dice en cada cuadro se acomodan dos electrones como máximo y se expresa su spin por medio de vectores. HUND propone una regla o principio de la máxima multiplicidad; que nos dice que en orbitales iguales no puede existir apareamiento electrónico mientras no exista por lo menos un electrón.
 |
| http://www.quimicafisica.com/sites/default/files/images/quimica-general/teoria-cuantica/pauli-hund.png |
Kernel
En la práctica, para simplificar la notación, los niveles de energía completos se indican con la referencia al gas noble correspondiente (el de número atómico inmediatamente menor) al que se añade la distribución de electrones en el nivel no completo. En el caso del vanadio:Gas noble precendente: 18 Ar: 1s2 2s2 2p6 3s2 3p6
Configuración electrónica del vanadio en kernel es: [Ar] 4s2 3d3
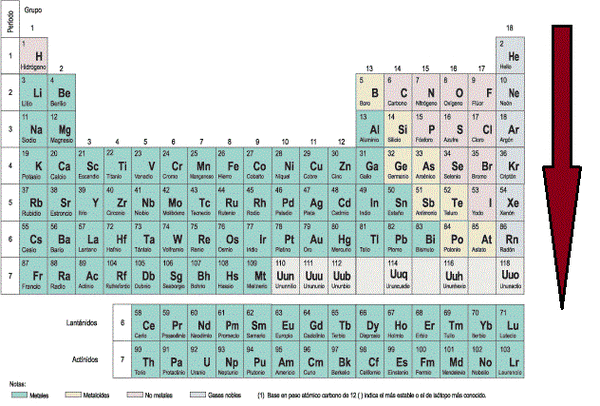
Grupos, periódos y bloques de la tabla periódica
La tabla periódica actual es un sistema donde se clasifican los elementos conocidos hasta la fecha.
Estos se clasifican de diferentes maneras:
Grupos de la tabla periódica
Numerados de izquierda a derecha utilizando números arábigos, según la última recomendación de la IUPAC (según la antigua propuesta de la IUPAC) de 1988[2] , los grupos de la tabla periódica son:
Grupo 1 (I A): los metales alcalinos
Grupo 2 (II A): los metales alcalinotérreos
Grupo 3 (III B) - Grupo 12 (II B): Metales de transición.
Grupo 13 (III A): Familia del boro
Grupo 14 (IV A): los carbonoideos o familia del carbono
Grupo 15 (V A): los nitrogenoideos o familia del nitrogeno
Grupo 16 (VI A): los calcógenos o anfígenos
Grupo 17 (VII A): los halógenos
Grupo 18 (VIII A): los gases nobles
Períodos de la tabla periódica
Las filas horizontales de la tabla periódica son llamadas períodos. Contrario a como ocurre en el caso de los grupos de la tabla periódica, los elementos que componen una misma fila tienen propiedades diferentes pero masas similares: todos los elementos de un período tienen el mismo número de orbitales. Siguiendo esa norma, cada elemento se coloca según su configuración electrónica. El primer período solo tiene dos miembros: hidrógeno y helio; ambos tienen sólo el orbital 1s.
La tabla periódica consta de 7 períodos
 |
| http://www.uam.es/docencia/elementos/spV21/figuras/usos.jpg |
Bloques s, p, d y f
La tabla también está dividida en cuatro grupos, s, p, d, f, que están ubicados en el orden sdp, de izquierda a derecha, y f lantánidos y actínidos. Esto depende de la letra en terminación de los elementos de este grupo, según el principio de Aufbau.Propiedades periódicas de los elementos
Los elementos químicos en la Tabla periódica están ordenados como ya sabemos por su número atómico. De hecho sus propiedades son funciones de su número atómico. Esto significa que el aumento o el descenso de una determinada propiedad esta relacionada con el orden de los números atómicos.
Electronegatividad: La electronegatividad es la tendencia que tiene un átomo de un cierto elemento a captar electrones. Si su electronegatividad es elevada significa que tiene mucha tendencia a atraer electrones de otro elemento que sería el dador. Los no metales son aceptores, es decir, electronegativos y los metales son electropositivos o sea, dadores de electrones. En la tabla periódica la electronegatividad aumenta de izquierda a derecha dentro de un mismo período y de abajo hacia arriba dentro de un grupo. El elemento más electronegativo es el Flúor y el más electropositivo es el Francio.
Radio atómico: Básicamente es la distancia que hay entre el centro del núcleo hasta el electrón más externo. Si estamos en un mismo nivel veremos que el número atómico crece hacia la derecha. Esto significa que un elemento ubicado más a la derecha tendrá mayor cantidad de electrones que su vecino de la izquierda. Al tener más electrones tendrá más protones (cargas positivas). Por lo tanto habrá más fuerza de atracción de los electrones hacia el núcleo y esto provocara una reducción aunque sea pequeña del radio atómico ya que la nube electrónica se acercara más al núcleo. En conclusión, los elementos ubicados más a la derecha dentro de un cierto nivel, tendrán menor radio atómico que los ubicados a la izquierda. Por eso, el radio atómico disminuye hacia la derecha.
 |
| https://bibliotecadeinvestigaciones.files.wordpress.com/2013/01/electronegatividad.png |
 |
| http://depa.fquim.unam.mx/QI/contenido/periodicidad_archivos/image075.jpg |
Potencial de ionización: Es la energía que hay que entregar para arrancarle el electrón más externo a un átomo en su estado neutro y gaseoso. Cuando se trata del electrón más externo hablamos de la primera energía o potencial de ionización y si se trata por ejemplo del segundo será la segunda energía o potencial de ionización. Con respecto a un grupo esta energía aumenta de abajo hacia arriba.Si ahora planteamos la misma situación a nivel de un periodo, o sea, horizontalmente, ocurre algo similar comparado con el radio atómico. Aumenta hacia la derecha porque hay mayor densidad electrónica en los elementos ubicados más a la derecha por tener mayor número atómico. Al estar con más electrones, habrán más protones y mayor atracción. Por este motivo se necesitara más energía o potencial para arrancarle algún electrón.
 |
| http://es-puraquimica.weebly.com/uploads/6/1/9/4/6194280/4348048.gif?587 Afinidad electrónica: es la cantidad de energía absorbida por un átomo aislado en fase gaseosa para formar un ión con una carga eléctrica de -1. Si la energía no es absorbida, sino liberada en el proceso, la afinidad electrónica tendrá, en consecuencia, valor negativo tal y como sucede para la mayoría de los elementos químicos; en la medida en que la tendencia a adquirir electrones adicionales sea mayor, tanto más negativa será la afinidad electrónica. De este modo, el flúor es el elemento que con mayor facilidad adquiere un electrón adicional, mientras que el mercurio es el que menos. |
Aunque la afinidad electrónica parece variar de forma caótica y desordenada a lo largo de la tabla periódica, se pueden apreciar patrones. Los no metales tienen afinidades electrónicas más bajas que los metales, exceptuando los gases nobles que presentan valores positivos por su estabilidad química, ya que la afinidad electrónica está influida por la regla del octeto.
 |
| http://depa.fquim.unam.mx/QI/contenido/periodicidad_archivos/image087.jpg |
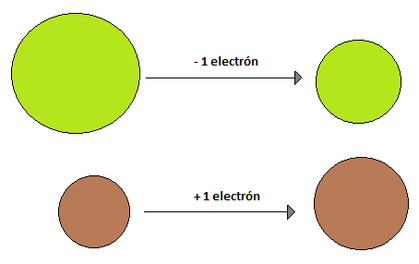
Radio Iónico: El radio iónico se define en relación a iones. Un ion es una especie química con carga, ya sea esta positiva o negativa, y se originan debido a que los elementos tratan de parecerse al gas noble más cercano (elementos del grupo 18), ya que estos tienen una estabilidad superior debido a que sus niveles energéticos se encuentran completos.La respuesta es la ganancia o pérdida de electrones. Como un átomo es eléctricamente neutro, cuando, por ejemplo, gana un electrón de más queda con cargado con un -1 mientras que si pierde un electrón queda cargado con un +1. La capacidad de un átomo para ganar o perder electrones está dado por su electronegatividad, electropositividad, energía de ionización y electroafinidad (propiedades que se verán más adelante). El radio iónico de una especie que ha perdido un electrón es menor que el radio atómico original, esto se debe a que como existe una carga positiva más que negativa, los electrones se sienten mucho más atraídos hacia el núcleo, reduciendo el radio. Por su parte, cuando un elemento gana un electrón, su radio iónico es mayor que su radio atómico de origen, debido a que ese último electrón que entró no se encuentra tan atraído hacia el núcleo y hace aumentar el radio.El radio iónico, al igual que su par atómico, aumenta a medida que se "baja" en un grupo, pero a diferencia del radio atómico, no presenta una tendencia clara de crecimiento en un periodo, ya que depende del ion.
 |
| http://es-puraquimica.weebly.com/uploads/6/1/9/4/6194280/3170829.png?421 |
 |
| http://es-puraquimica.weebly.com/uploads/6/1/9/4/6194280/6517256.gif?601 |
Fuentes de Información
http://portalacademico.cch.unam.mx/alumno/quimica1/u2/modelos_atomicos/modelosatomicos
http://portalacademico.cch.unam.mx/alumno/quimica1/unidad2/modelos_atomicos/bibliografia
http://www.quimicaweb.net/grupo_trabajo_fyq3/tema4/index4.htm
http://cienciaaldia2011.webnode.es/quimica-901/iii-periodo/lecturas/lecturas-de-profundizacion/grupos-periodos-bloques-de-la-tabla-periodica/
http://www.quimicayalgomas.com/quimica-general/propiedades-periodicas-de-los-elementos/
http://enciclopedia.us.es/index.php/Afinidad_electr%C3%B3nica




Muy buena recopilación de información, solamente recuerden que no se trata de copiar y pegar información .
ResponderBorrarSAludos Cordiales
Hilda Cisneros