Hecho por:
LUIS ADOLFO LUNA PATIÑO
ALEJANDRO GARCIA JIMENEZ
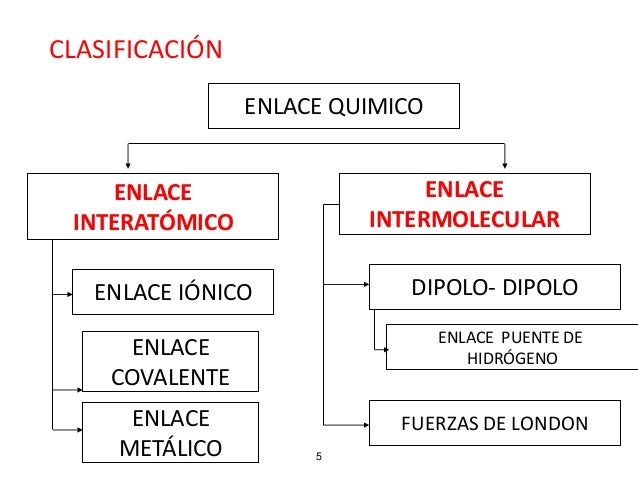
BLOQUE III : ENLACES QUÍMICOS E INTERACCIONES MOLECULARES
Definición: Cuando los átomos se unen para formar moléculas, hay un intercambio de electrones de valencia, esto es, de los electrones de la capa más externa de cada átomo.Esta unión, que es la más estable, se logra porque los átomos ganan, pierden o comparten electrones, y la atracción resultante entre los átomos participantes recibe el nombre de enlace químico.
 |
| http://image.slidesharecdn.com/enlacesquimicos-140416152742-phpapp01/95/enlaces-quimicos-5-638.jpg?cb=1397662104 |
Regla del Octeto
Los átomos de los elementos representativos forman enlaces de tal manera que tengan acceso a exactamente OCHO electrones s y p externos o electrones de valencia.
Los átomos tienden a completar sus últimos niveles de energía con una cantidad de electrones adquiriendo una configuración semejante a la de un gas noble.
- Un METAL puede PERDER de UNO A TRES ELECTRONES para formar un catión con la estructura del gas noble que lo antecede en la tabla periódica.
- Un NO METAL puede GANAR de UNO A TRES ELECTRONES para formar un ANIÓN con la estructura del gas noble siguiente.
- Los átomos pueden compartir electrones con otros átomos para alcanzar el número de electrones del gas noble siguiente.
 |
| https://upload.wikimedia.org/wikipedia/commons/f/fd/Octeto.png |
ENLACE IÓNICO
Es la unión de un no metal de BAJA ELECTRONEGATIVIDAD con un NO METAL DE ALTA ELECTRONEGATIVIDAD.
en estos enlaces se realiza la transferencia de uno o más electrones de un átomo a otro grupo de átomos.
PROPIEDADES:
- Tienen puntos de fusión y ebullición elevados.
- Son solubles en disolventes polares.
- En solución químicamente activos.
- Fundidos o en disolución acuosa son buenos conductores de la corriente eléctrica
ENLACE COVALENTE
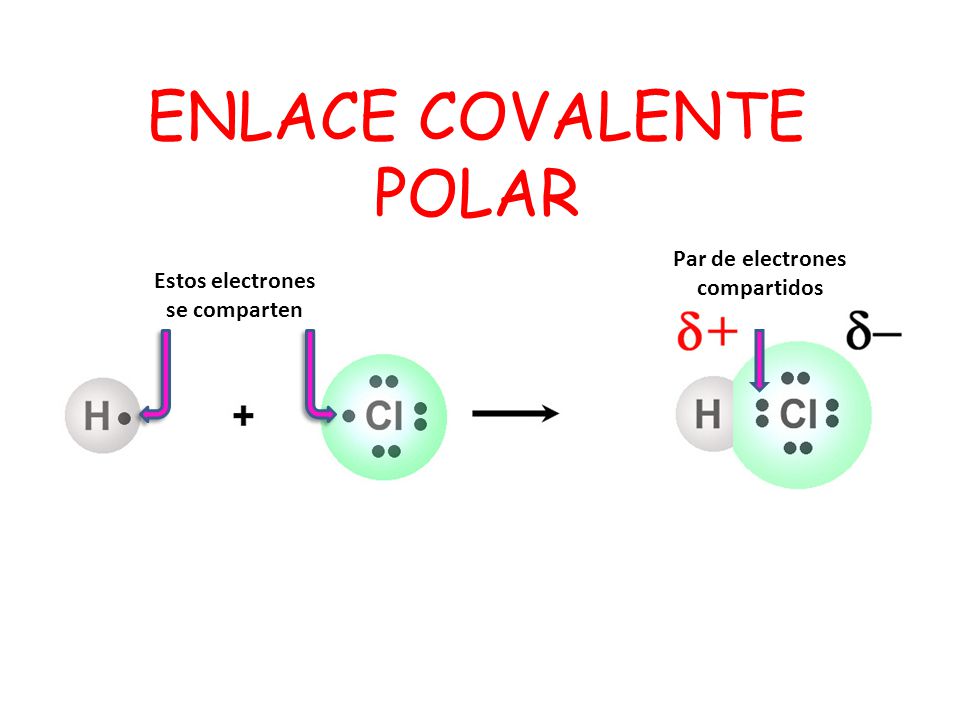
En un enlace covalente polar uno de los átomos ejerce una atracción mayor sobre los electrones de enlace que otro. Esto depende de la electronegatividad de los átomos que se enlazan. Cuando la diferencia de electronegatividad entre los átomos de enlace está entre 0.5 y 2.0, la desigualdad con que se comparten los electrones no es tan grande como para que se produzca una transferencia completa de electrones; el átomo menos electronegativo aún tiene cierta atracción por los electrones compartidos.
Los enlaces covalentes polares se llaman polares porque al compartir desigualmente los electrones se generan dos polos a través del enlace; un enlace covalente polar tiene polos positivo y negativo separados. El polo negativo está centrado sobre el átomo más electronegativo del enlace y el polo positivo está centrado sobre el átomo menos electronegativo del enlace.- Pueden presentarse por átomos de elementos NO METALICOS.
- Son malos conductores de calor y electricidad.
- Tienen un punto de fusión y ebullición bajos.
Covalento No Polar: Se da cuando el enlace lo forman dos átomos del mismo elemento, y la diferencia de electronegatividades es cero.
 |
| http://images.slideplayer.es/7/1672737/slides/slide_20.jpg |
GEOMETRÍA MOLECULAR
ENLACE METÁLICO
El enlace metálico ocurre entre dos átomos de metales. En este enlace todos los átomos envueltos pierden electrones de sus capas mas externas, que se trasladan más o menos libremente entre ellos, formando una nube electrónica (también conocida como mar de electrones).
Los átomos de los metales tienen pocos electrones en su última capa, por lo general 1, 2 ó 3. Éstos átomos pierden fácilmente esos electrones (electrones de valencia) y se convierten en iones positivos. Los iones positivos resultantes se ordenan en el espacio formando la red metálica. Los electrones de valencia desprendidos de los átomos forman una nube de electrones que puede desplazarse a través de toda la red. De este modo todo el conjunto de los iones positivos del metal queda unido mediante la nube de electrones con carga negativa que los envuelve.
FUERZAS DE INTERACCIÓN MOLECULAR
Interacción Dipolo-Dipolo
La interacción dipolo-dipolo es la observada entre un dipolo positivo de una molécula polar con el dipolo negativo de otra. En los enlaces covalentes polares, el átomo con mayor electronegatividad atrae los electrones hacia sí, formándose un dipolo negativo en torno al mismo. En el átomo con menor electronegatividad, el dipolo formado es de carga positiva, ya que cede parcialmente sus electrones. Las atracciones electrostáticas entre dipolos de carga contraria, de diferentes moléculas son las llamadas interacciones dipolo-dipolo.
La fuerza de este tipo de interacción es bastante débil, de un promedio de 4 kJ por mol, en comparación con la energía de enlaces covalentes o iónicos.
Existen varios tipos de interacción dipolo-dipolo:
Interacción dipolo permanente. Es el que ocurre entre dos moléculas cuyos enlaces son covalentes polares, es decir, que forman dipolos por diferencia de electronegatividad entre sus átomos.
Interacción dipolo inducido. Se produce cuando en moléculas no polares, el dipolo es inducido, por ejemplo mediante un campo eléctrico.
Fuerzas de Dispersión (de London)
Las fuerzas de dispersión, también conocidas como fuerzas de dispersión de London, en honor al científico Fritz London, son unas fuerzas de tipo intermolecular. Dichas fuerzas tienen lugar entre moléculas de tipo no polar, donde pueden encontrarse dipolos.
Cuando se representan los orbitales de átomos y moléculas, la distribución de los electrones, es decir, la densidad electrónica, es el valor promediado en el tiempo. Lo que da origen a la atracción entre moléculas vecinas son las oscilaciones respecto a dicho valor promediado en el tiempo. Los átomos de los gases nobles nos proporcionan el ejemplo más sencillo. En promedio, la densidad electrónica debería ser esféricamente simétrica alrededor del núcleo atómico. Sin embargo, la gran parte del tiempo, los electrones tienen una distribución asimétrica; en consecuencia de esto, una parte del átomo tiene una densidad electrónica mayor y en otra la densidad electrónica es menor.
El lado o extremo en el que el núcleo se encuentra parcialmente expuesto, es ligeramente más positivo (δ+), y el extremo hacia el que la densidad electrónica se ha desplazado tiene una carga parcial negativa (δ-). Dicha separación de cargas se conoce como dipolo temporal. El núcleo parcialmente expuesto de un átomo atrae densidad electrónica de un átomo vecino y es este dipolo inducido entre las moléculas lo que representa la fuerza de dispersión entre los átomos y las moléculas. Sin embargo, un instante después la densidad electrónica ya se ha desplazado, y las cargas parciales que causan la atracción se han cambiado.
La intensidad de la fuerza de dispersión depende de cierto número de factores. Sin embargo, dar un enfoque cualitativo y predictivo debe considerar que las fuerzas de dispersión se relacionan con el número de electrones que se encuentren en el átomo o en la molécula.
 |
| https://unidosporlaciencia.files.wordpress.com/2014/11/21.jpg |
PUENTE DE HIDRÓGENO
El enlace de por puente de hidrógeno en realidad no es un enlace propiamente dicho, sino que es la atracción experimentada por un átomo electronegativo y un átomo de hidrógeno que están formando parte de distintos enlaces covalentes polares.
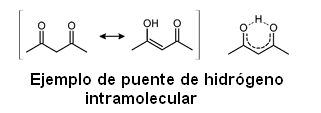
El átomo con mayor electronegatividad atraerá hacia si los electrones del enlace, formándose un dipolo negativo, mientras que el átomo de hidrógeno, al ceder parcialmente sus electrones, genera un dipolo de carga positiva en su entorno. Estas cargas opuestas se atraen.
El puente de hidrógeno es un caso especial de la interacción dipolo-dipolo. El enlace por puente de hidrógeno puede ser intermolecular (en el caso del agua por ejemplo) o puede darse también dentro de una misma molécula, siendo denominado en este caso puente de hidrógeno intramolecular.
BLOQUE IV: COMPUESTOS QUÍMICOS INORGÁNICOS
Un ion monoatomico es una especie química, ya sea un átomo o molécula cargada electricamente debido a que ha ganado o perdido electrones como consecuencia de una reacción química.
Los iones con carga negativa producidos por la ganancia de electrones reciben el nombre de ANIONES, y los que poseen carga positiva debido a la perdida de electrones reciben el nombre de CATIONES.
Estado de Oxidación.
El número o estado de oxidación tiene signo porque considera a las unidades como iónicas por lo tanto es positivo si el átomo pierde electrones o los comparte con un átomo que tenga tendencia a ganarlos (más electronegativos). Es negativo si el átomo gana electrones.
Valencia
A la capacidad que tienen los elementos para ganar o perder electrones de le llama Valencia, en algunos elementos la valencia coincide con el grupo al que pertenecen. La valencia son los electrones que ese átomo pone en juego en su enlace.- Los elementos en su estado natural tienen un numero de oxidacion de cero: Ne, Ar, He, H2, O2, Br2, N2, I2,Au, Ag.
- Los metales en su formación ionica tienen numero de oxidación positivo.
- Los iones de metales alcalinos tienen un numero de oxidación de +1.
- Los iones de lo metales alcalinoterreos tienen un numero de oxidación de +2.
- En un compuesto la suma algebraica de los números de oxidación debe ser cero.
CONSTRUCCIÓN DE FORMULAS DE LOS COMPUESTOS QUMICOS
Todos los compuestos son electricamente neutros. La valencia y el numero de oxidación son dos conceptos importantes en una formula química; primero se escribe el cation (+) y posteriormente el anion (-).
- Si la valencia o estado de oxidación del cation y anion es el mismo se ignoran y se escribe:
- Si el estado de oxidación de catión y anión son múltiplos, se intercambian las valencias (la del catión se convierten en subíndice del anión y la del anión se convierte en el subíndice del catión), Se escriben como subíndices y se queda sólo el múltiplo).
- Si no son múltiplos se intercambian las valencias y permanece así.
- Los compuestos químicos inorgánicos pueden ser "binarios, ternarios o polinarios". Se nombran de derecha-izquierda.
OXIÁCIDOS MO ( Metal + Oxígeno)
Nomenclatura: Oxido+de+nombre del metal+numero romano
HIDRÓXIDOS MOH (Metal + Hidróxido)
Nomenclatura: Prefijo+oxido+de+nombre del no metal
 |
| http://image.slidesharecdn.com/equipo2oxidosmetalicosynometalicos2-150805201004-lva1-app6892/95/xidos-metlicos-y-no-metlicos-14-638.jpg?cb=1438805602 |
SALES BINARIAS MX (Metal + No Metal)
Nomenclatura: Raíz de no metal+uro+de+nombre metálico
OXISALES MXO (Metal + No Metal + Oxígeno)
Nomenclatura:
 |
| http://image.slidesharecdn.com/nomenclaturadelassalesequipo5-120302125649-phpapp01/95/nomenclatura-de-las-sales-equipo-5-4-728.jpg?cb=1330693183 |
HIDRUROS (Metal + Hidrógeno)
 |
| http://image.slidesharecdn.com/hidrurosmetalicoshhhw-150805201138-lva1-app6892/95/hidruros-metalicos-5-638.jpg?cb=1438805766 |
Estado de Oxidación.
El número o estado de oxidación tiene signo porque considera a las unidades como iónicas por lo tanto es positivo si el átomo pierde electrones o los comparte con un átomo que tenga tendencia a ganarlos (más electronegativos). Es negativo si el átomo gana electrones.
Construcción de Fórmulas de los Compuestos Químicos
A la capacidad que tienen los elementos para ganar o perder electrones de le llama Valencia, en algunos elementos la valencia coincide con el grupo al que pertenecen. La valencia son los electrones que ese átomo pone en juego en su enlace.
- Los elementos en su estado natural tienen un numero de oxidacion de cero: Ne, Ar, He, H2, O2, Br2, N2, I2,Au, Ag.
- Los metales en su formación ionica tienen numero de oxidación positivo.
- Los iones de metales alcalinos tienen un numero de oxidación de +1.
- Los iones de lo metales alcalinoterreos tienen un numero de oxidación de +2.
- En un compuesto la suma algebraica de los números de oxidación debe ser cero.
CONSTRUCCIÓN DE FORMULAS DE LOS COMPUESTOS QUMICOS
Todos los compuestos son electricamente neutros. La valencia y el numero de oxidación son dos conceptos importantes en una formula química; primero se escribe el cation (+) y posteriormente el anion (-).
- Si la valencia o estado de oxidación del cation y anion es el mismo se ignoran y se escribe:
- Si el estado de oxidación de catión y anión son múltiplos, se intercambian las valencias (la del catión se convierten en subíndice del anión y la del anión se convierte en el subíndice del catión), Se escriben como subíndices y se queda sólo el múltiplo).
- Si no son múltiplos se intercambian las valencias y permanece así.
- Los compuestos químicos inorgánicos pueden ser "binarios, ternarios o polinarios". Se nombran de derecha-izquierda.
REFERENCIAS
: Enlace por puente de hidrógeno | La Guía de Química http://quimica.laguia2000.com/conceptos-basicos/enlace-por-puente-de-hidrogeno#ixzz4AArhTcUI
Fuerzas de dispersión (de London) | La Guía de Química http://quimica.laguia2000.com/general/fuerzas-de-dispersion-de-london#ixzz4AApyV7YO
Interacción dipolo-dipolo | La Guía de Química http://quimica.laguia2000.com/general/interaccion-dipolo-dipolo#ixzz4AAoeEl






